该研究的人类TSEN/CLP1/pretRNA复合物在催化前和催化后状态下的结构为理解pre-tRNA剪接的机制提供了一个框架。 从tRNA前体 (pre-tRNA)中去除内含子在生命的三个王国中都是必不可少的。在人类中,这一过程是由tRNA剪接内切酶(TSEN)介导的,包括四个亚基:TSEN2、TSEN15、TSEN34和TSEN54。
2023年4月6日,西湖大学施一公团队在Molecular Cell (IF=19)在线发表题为“Structural basis of pre-tRNA intron removal by human tRNA splicing endonuclease”的研究论文,该研究揭示了人tRNA剪接核酸内切酶去除tRNA前体内含子的结构基础。该研究报道了人TSEN在催化前和催化后的平均分辨率分别为2.94和2.88 Å下与全长pre-tRNA结合的冷冻电镜结构。
人体TSEN具有一个延伸的表面凹槽,容纳l型的pre-tRNA。pretRNA的成熟结构域由TSEN34、TSEN54和TSEN2的保守结构元素识别。这种识别定位pre-tRNA的反密码子茎,并将30剪接位点和50剪接位点分别放置在TSEN34和TSEN2的催化中心。大部分内含子序列与TSEN没有直接的相互作用,这解释了为什么不同内含子的pre-tRNAs可以被容纳和裂解。该结构揭示了TSEN pre-tRNA裂解的分子尺机制。
转运RNA (tRNA)对于遗传信息的流动至关重要,它允许核糖体将mRNA翻译成蛋白质。成熟tRNAs是由tRNAs前体 (pre-tRNAs)通过一系列转录后处理和修饰步骤生成的。在生命的三个王国中,对于pre-tRNAs的一个子集,内含子序列都存在,必须通过剪接去除。在人类基因组中预测的tRNA基因中,至少有28个含有长度和序列不同的内含子。在古生菌和真核生物中,内含子通过tRNA剪接内切酶(TSENs)去除,然后通过涉及特定tRNA连接酶的多步骤过程连接两个释放的外显子。
真核生物TSEN包括两个催化亚基TSEN34和TSEN2,两个结构亚基TSEN54和TSNE15,TSEN34和TSEN2分别在30剪接位点(30SS)和50剪接位点(50SS)切割pre-tRNA。在哺乳动物中,多核苷酸激酶CLP1与TSEN共纯化。尽管CLP1在体外tRNA切割前是可有可无的,但CLP1和所有TSEN亚基的突变已与tRNA代谢改变和神经病变相关。 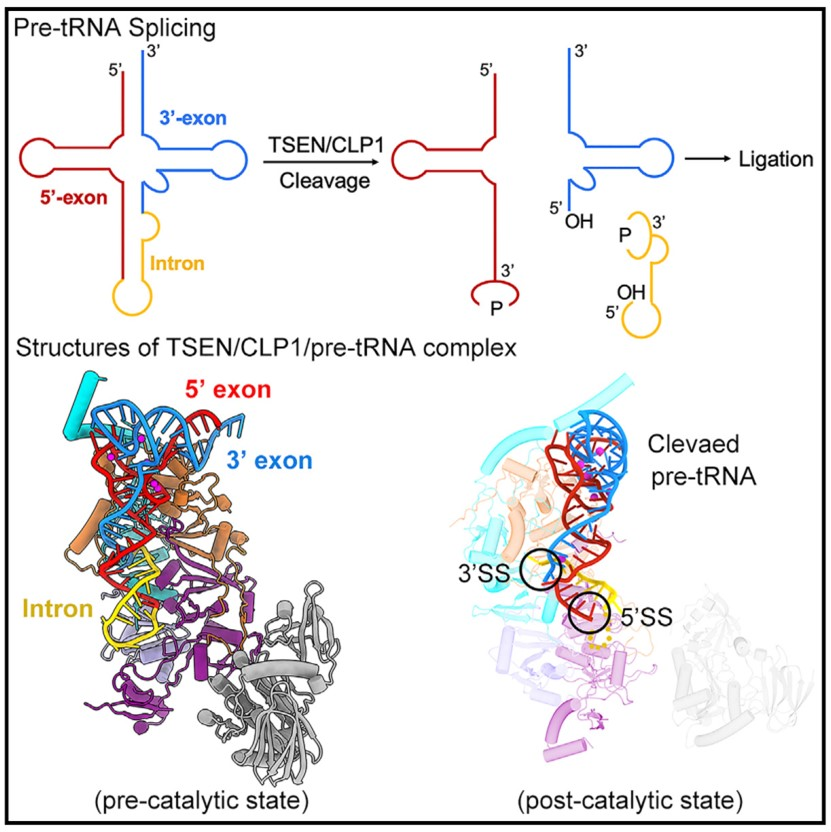
机理模式图(图源自Molecular Cell )
自从20世纪70年代发现tRNA内含子以来,广泛的生化和晶体学研究中对各种类型的TSENs的pre-tRNA裂解有了相当大的了解。特别地,古生菌TSEN与隆起-螺旋-隆起(BHB) RNA基序复合物的结构揭示了一些关键的相互作用,这些相互作用是pre-tRNA识别和切割所必需的。然而,关于真核生物TSEN的结构信息出现缓慢,严重限制了对pre-tRNA裂解机制的理解。例如,TSEN被认为采用分子尺机制来识别pre-tRNA的两位点切割,但由于缺乏被TSEN结合的全长pre-tRNA的结构信息,其基础仍不充分。此外,四个TSEN亚基是如何被组织成一个完整的、具有两个独立活性位点的内切酶的仍不清楚。
该研究报道了人类TSEN与全长pre-tRNA结合的两个高分辨率结构:一个处于催化前状态,另一个处于催化后状态。为了捕捉预催化状态,作者在TSEN中引入了两个错意突变:TSEN34中的H255A和TSNE中的H377A。
总之,该研究的人类TSEN/CLP1/pretRNA复合物在催化前和催化后状态下的结构为理解pre-tRNA剪接的机制提供了一个框架。