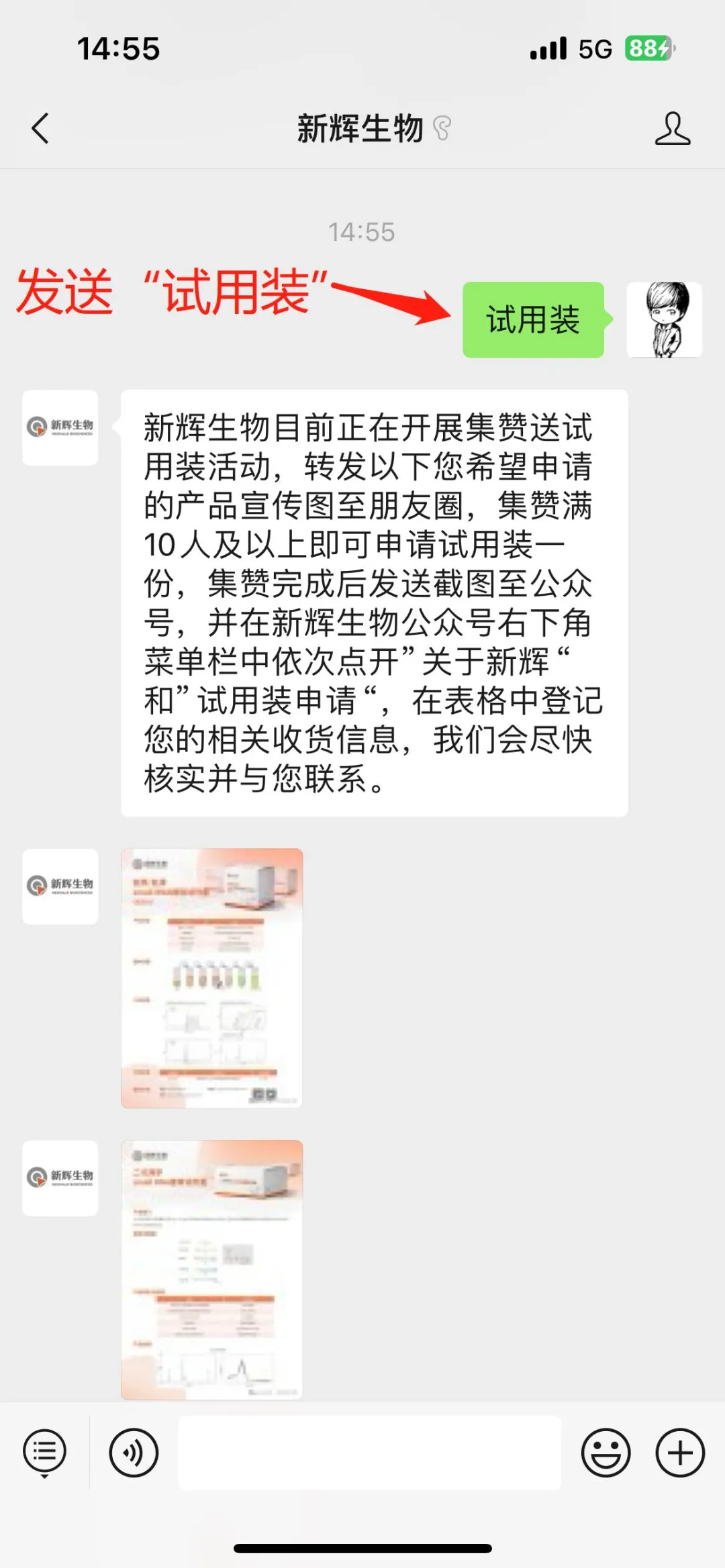
新辉生物是一家专注于核酸研究上游的试剂及仪器平台供应商,主要从事纳米材料和生物芯片类产品的开发及推广应用,并以此服务于公共健康和生命科学。
产品中心
助力cfRNA检测应用领域的快速发展
-
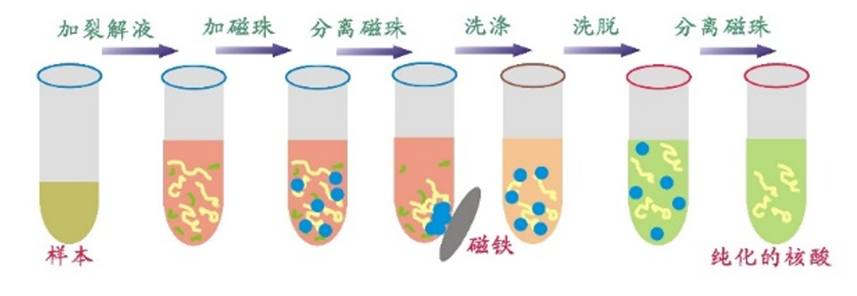
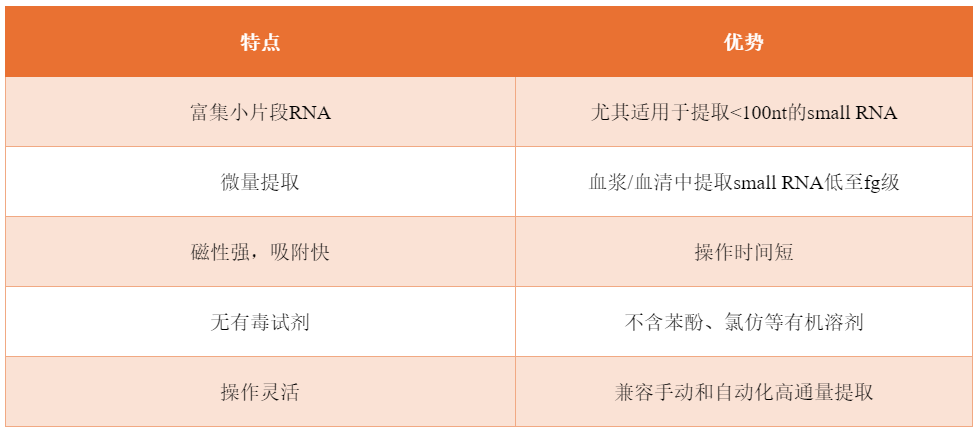
血浆/血清small RNA提取试剂盒
-
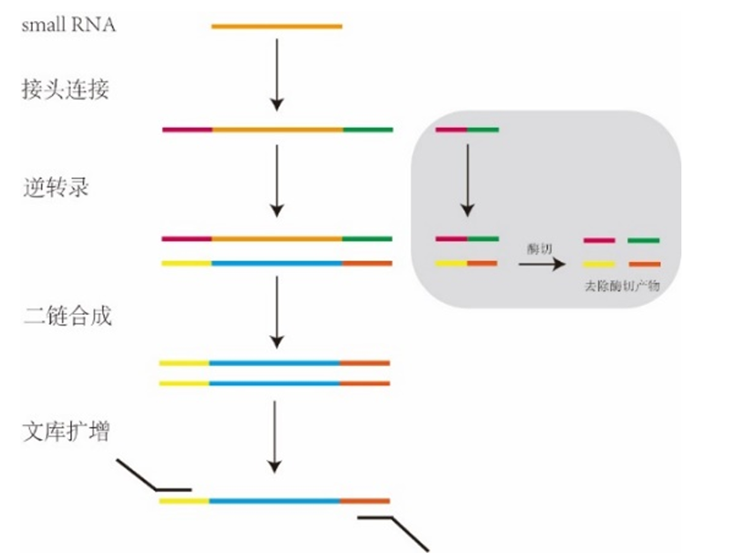
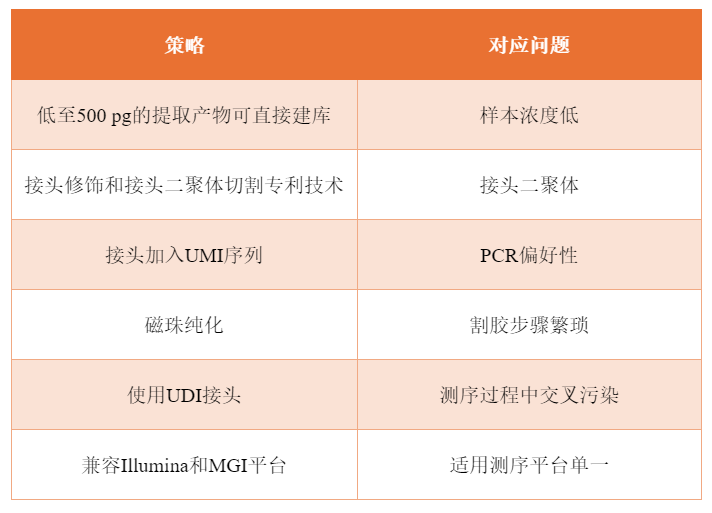
二代测序 small RNA建库试剂盒
-
可编程数字微流控通用平台
-
胞嘧啶快速转化试剂盒

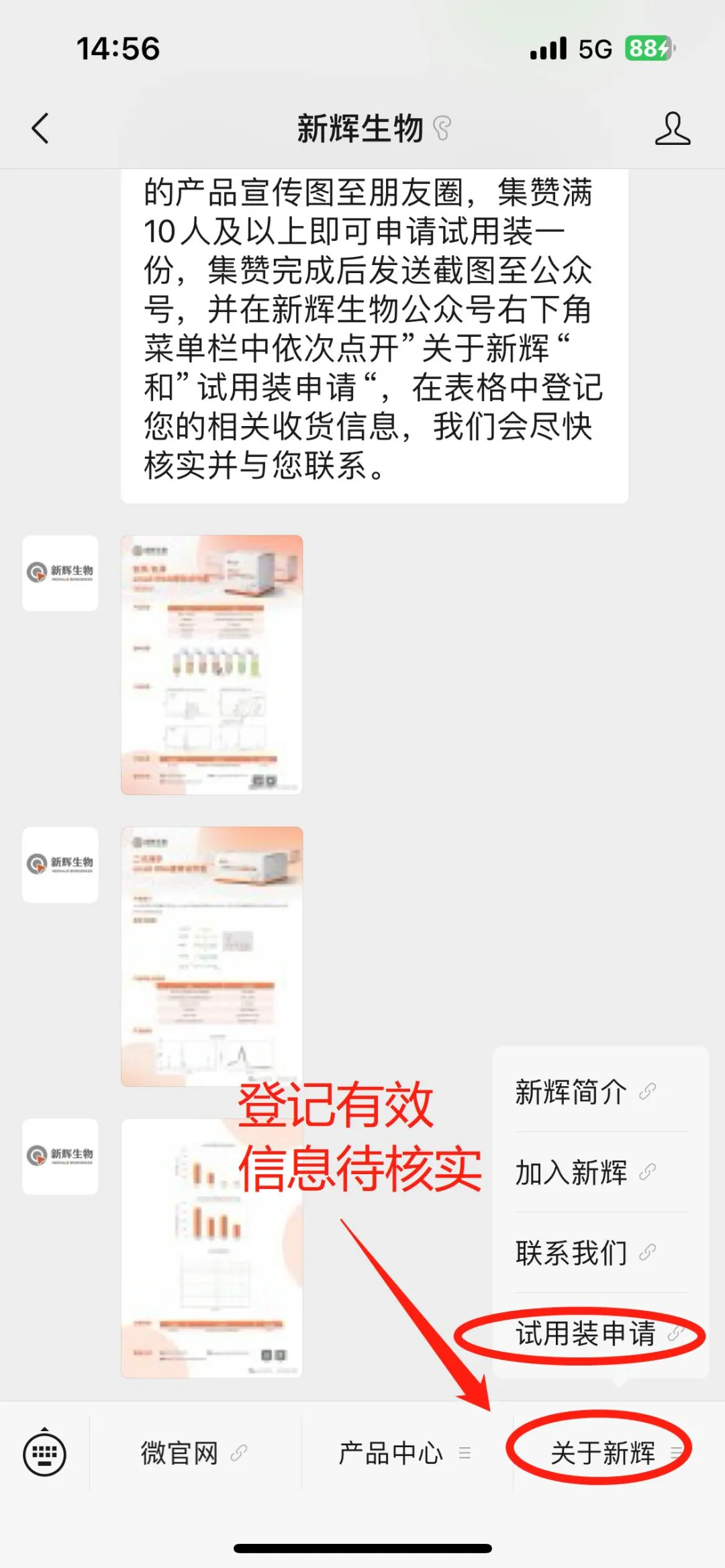
关于新辉
杭州新辉生物技术有限公司(HangZhou Neohalo Biotechnology Co.,Ltd.)是香港交易所上市公司诺辉健康(6606.HK)的全资子公司,成立于2022年4月,位于中国浙江自由贸易试验区。新辉生物是一家专注于核酸研究上游的试剂及仪器平台供应商,主要从事纳米材料和生物芯片类产品的开发及推广应用,并以此服务于公共健康和生命科学。公司尤其致力于开发国际领先的游离RNA(cfRNA)研究相关试剂及设备,目前已经推出基于介质电润湿原理的数字微流控技术平台,可广泛应用于微量样本制备,荧光定量PCR,数字PCR,NGS和单细胞建库等各种科研和临床场景。同时也推出了自主研发的、基于硅磁聚体(SMAGG)专利技术的微量small RNA提取试剂盒和基于接头自连产物去除专利技术的微量small RNA建库试剂盒。此外,公司目前已经通过ISO9001质量管理体系,最大程度上保证了研制产品的质量稳定可靠,助力cfRNA检测应用领域的快速发展。
-

研发能力
R&D Capability
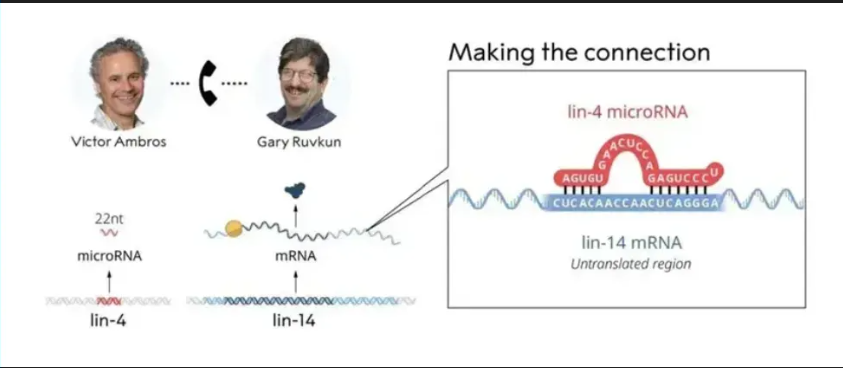
新辉生物尤其致力于开发国际领先的游离RNA(cfRNA)研究相关试剂及设备。
-

专利技术
Patent system
基于硅磁聚体(SMAGG)专利技术的微量small RNA分离纯化试剂盒和基于接头自连产物去除专利技术的微量small RNA文库构建试剂盒,后续还将推出基于介质电润湿原理的数字微流控技术平台。
-

平台建设
Platform construction
公司在杭州设有十万级洁净生产车间,最大程度上保证了研制产品的质量稳定可靠。
行业资讯
关注cfRNA检测应用领域的快速发展