-
21
04月

揭秘生命的密码,新辉生物亮相生命科学新品(招商)推介会暨产业链展,推出small RNA提取及建库试剂盒!
在生命的宏伟交响乐中,small RNA无疑是其中不可或缺的一部分。small RNA是指长度在200nt以内的非编码RNA,包括miRNA、siRNA 、 piRNA、snRNA等。small RNA广泛存在于生物体内,是一类重要的功能分子。它们微小而精致,却在细胞内部发挥着至关重要的作用,调控着基因的表达,参与着各种生命活动。 研究发现,small RNA在肿瘤的病理过程中起着重要作用,能够诱导靶基因表达的不稳定性,抑制肿瘤细胞的增殖和转移。而在神经系统中,small RNA也发挥着关键的调控作用,影响着神经细胞的生长、分化和功能。随着技术的不断进步,我们对small RNA的认识也在不断深化。 高通量测序技术具有检测完全且准确度高,可重复性好,通量高等优点,在探索研究small RNA上具有巨大优势。当然想要开展高通量测序实验,必然缺少不了样本提取与建库的流程。 今天,就让我们一起踏上small RNA提取与建库的神奇之旅,并深入探索这些微小分子的生物学功能。首先,我们聊聊small RNA的提取。这一过程就如同从生命的海洋中筛选出那闪耀的珍珠,科学家们凭借精密的实验设计和专业的试剂,小心翼翼地从复杂的细胞环境中提取出这些珍贵的small RNA分子。 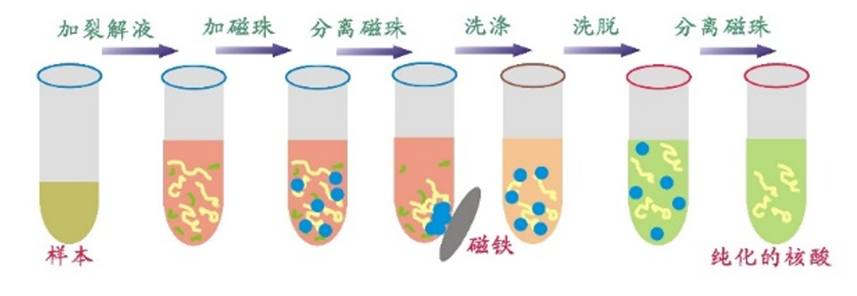
新辉自主研发的血浆/血清small RNA提取试剂盒,其裂解液能高效破坏样本中有细胞膜结构的成分,并使蛋白变性释放核酸,同时使用具有专利结构的硅磁聚体(SMAGG)吸附small RNA,并利用SMAGG可逆磁响应的物理性质富集和清洗非特异性结合的杂质和盐,使用洗脱液将纯化后的small RNA从磁性微球中分离,得到满足下游检测需求的small RNA。
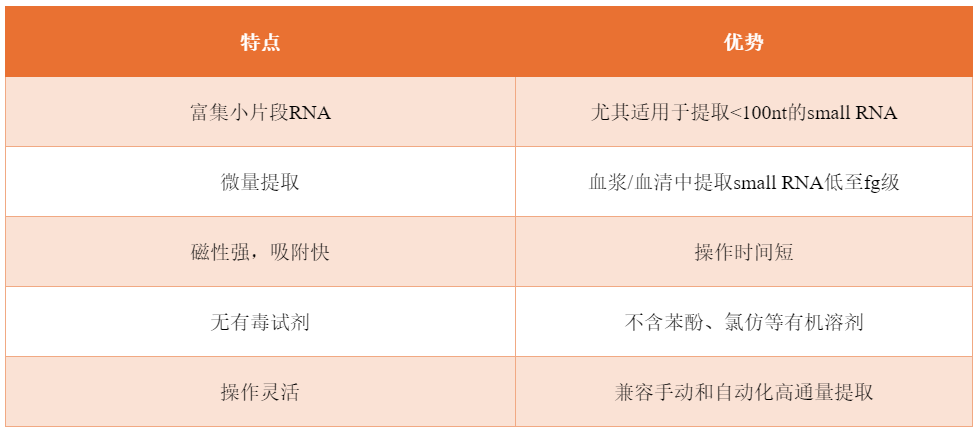
接下来,是关键的建库环节。建库,就像是为这些small RNA搭建一个家园,让它们能够有序地生活在一起。科学家们运用高通量测序技术,将提取到的small RNA进行扩增和标记,构建出一个包含大量small RNA信息的文库。这个文库就像是一本生命的百科全书,记录着small RNA的种类、数量和功能。
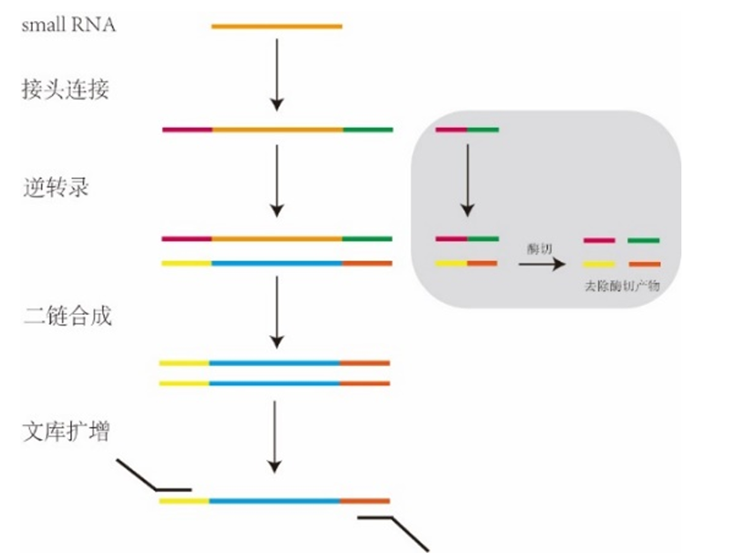
新辉生物建库试剂盒采用独有的接头自连产物去除专利技术,实现了对微量small RNA样本的文库构建,同时选择使用一管式反应流程进一步减少了文库构建起始模板的投入量。
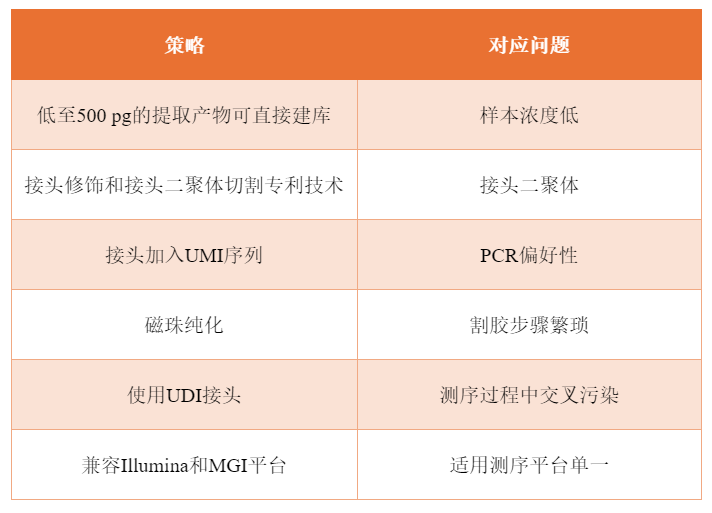
新辉生物开发的small RNA建库试剂盒适用于起始量为500pg~20ng不同样本来源的small RNA样本,经过接头连接、逆转录、二链合成和PCR扩增,经过文库构建最终转化为适用于Illumina及MGI平台测序的文库,根据实验测试,新辉试剂盒文库产量及miRNA检出种类数远高于国内外竞品,同时也验证了试剂批间性能稳定 在这场small RNA提取与建库的奇妙之旅中,我们不仅能够领略到生命科学的魅力,更能够感受到科学的力量。通过研究small RNA,我们能够更深入地研究这些微小分子的功能,揭示它们与生命活动的关联,为未来的医学研究和治疗策略提供新的思路和方向。让我们期待这场旅程能够继续深入,为人类揭开更多生命的奥秘,为人类的健康和福祉带来更多的突破和惊喜!
杭州新辉生物技术有限公司成立于2022年4月,是一家核酸研究的上游试剂及仪器平台供应商,位于中国浙江自由贸易试验区。新辉生物专注于纳米材料和生物芯片类产品的开发及推广应用,并以此服务于公共健康和生命科学。我们尤其致力于研发国际领先的cfRNA检测相关技术及产品,目前已推出基于硅磁聚体(SMAGG)专利技术的微量small RNA分离纯化试剂盒和基于接头自连产物去除专利技术的微量small RNA文库构建试剂盒。新辉生物目前业务正处于快速发展阶段。在本次Distrimap招商会上,新辉生物希望能在全国携手志同道合的代理商朋友,让广大的中国科研工作者都能获得满足需求的small RNA提取及建库全流程解决方案。

会议名称:生命科学新品(招商)推介会暨产业链展
会议时间:2024年4月23日-24日
会议地点:苏州香格里拉大酒店
会议地址:苏州市新区塔园路168号

-
09
11月

Nature:新发现!揭示癌细胞中线粒体发挥功能的关键信息,有望开发出新型癌症疗法
近日,一篇发表在国际杂志Nature上题为“Spatial mapping of mitochondrial networks and bioenergetics in lung cancer”的研究报告中,来自加州大学洛杉矶分校等机构的科学家们通过研究利用正电子发射断层扫描技术(PET)与电子显微镜相结合,在遗传工程化修饰的小鼠机体的肺部肿瘤中产生了线粒体网络的三维超分辨率图谱。
文章中,研究人员根据线粒体的活性和其它因素,利用一种称之为深度学习的人工智能技术来对肿瘤进行分类分析,并量化了整个肿瘤中数百个细胞和数千个线粒体的结构。研究人员对两种主要的非小细胞肺癌(NSCLC)亚型—肺腺癌和鳞状细胞癌进行了研究,并在这些肿瘤内部发现了不同的线粒体网络亚群;更为重要的是,他们还发现,线粒体能经常与诸如脂滴等细胞器组织在一起并产生特殊的亚细胞结构,同时还能支持肿瘤细胞的代谢和线粒体活性。

图片来源:Nature (2023). DOI:10.1038/s41586-023-05793-3
研究者推测,人类癌症样本中的线粒体群体并不会与各自的肿瘤亚型相互排斥,而是会存在一种活性谱;这些研究发现或许就为理解癌细胞中线粒体的功能提供了关键的信息,并有望帮助开发出新型癌症疗法。
研究者Shackelford说道,我们的研究代表了利用遗传工程化小鼠模型来生成高度详细的肺部肿瘤三维图谱的关键第一步;利用这些图谱,我们就能产生肺部肿瘤的结构和功能蓝图,并能提供非常有价值的线索来揭示肿瘤细胞是如何在结构上组织其细胞架构来对肿瘤生长的高代谢需求产生反应的,我们的研究发现或许有望帮助指导并改善当前的癌症疗法策略,同时还能阐明科学家们治疗肺癌疗法的新方向。 本文研究揭示了肺部肿瘤代谢通量的一个新的发现成果,并阐明了癌细胞对营养的偏好或许是由其细胞中线粒体和其它细胞器的区室所决定的,即要么依赖于葡萄糖,要么依赖于游离脂肪酸。
本文研究结果对于开发能够靶向作用肿瘤特异性的营养偏好的有效抗癌疗法具有非常重要的意义,这种多模式成像方法也能促使研究人员揭开癌症代谢此前未知的方面,研究人员认为,这或许也能应用于对其它类型癌症的研究中。 综上,本文研究结果表明,在非小细胞肺癌中,线粒体网络能被分隔成为不同的亚群,并支配着肿瘤的生物能量能力。